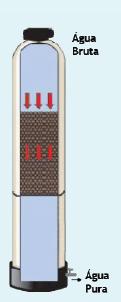
Quando a água bruta fica potável
Por Cristiane Rubim
Edição Nº 7 - junho/julho de 2012 - Ano 2
Da primeira à última etapa do tratamento de água
Nesta segunda matéria da edição especial, vamos de uma ponta à outra do tratamento da água falando da fase inicial e final de todo o processo. A etapa que antecede começa ainda no manancial com a utilização dos algicidas para evitar a proliferação de algas e a poluição e a última é a de prevenir a corrosão dos encanamentos com uso de produtos químicos para correção de acidez e alcalinidade e formação de uma camada protetora com carbonato de sódio (barrilha leve) para o fluxo saudável da água.
Algicidas
O algicida atua no combate do desenvolvimento e proliferação de algas azuis ou verdes (água esverdeada) em áreas aquáticas, o que gera sujeira. Por isso, o tratamento da água começa ainda no manancial com os algicidas. Para protegê-lo, é preciso combater também a poluição causada por detritos, impurezas e lixos domésticos, agrícolas ou industriais. A hidrobiologia cuida do crescimento excessivo de algas e micro-organismos e, quando os níveis são ultrapassados, é realizada a desinfecção com sulfato de cobre ou hipoclorito de sódio, conforme a sensibilidade das algas. Este produto químico é utilizado em piscinas, represas, lagos, locais de armazenamento e distribuição de água para consumo e uso industrial.
Os principais algicidas são: sulfato de cobre, alguns sais de ferro, acetato de fentina, cloretos, hipocloretos de cálcio e de sódio, entre outros.
Sulfato de cobre
O sulfato de cobre (II) ou sulfato cúprico é um sal que possui formas diferentes, dependendo do grau de hidratação. Como anidro, de fórmula CuSO4, apresenta-se como um pó de coloração verde opaca ou cinzento, vindo do mineral chamado calcocianita. Já como pentaidratado (CuSO4.5H2O), o mais encontrado, é azul brilhante, extraído da calcantita. Com alta toxicidade, o sulfato de cobre é obtido por ustulação do sulfeto de cobre que, depois, reage com ácido sulfúrico. É utilizado na impressão de tecidos de algodão, fabricação de artesanato de cobre, inseticidas, no tratamento de fibras, tinturas para cabelo, coloração de vidro e processamento de couro. Na agricultura, o pentaidratado tem funções herbicida, algicida, fungicida e bactericida. Já o anidro é usado na detecção de umidade. Considerado um composto perigoso, pode causar irritação nas mucosas e pele.
Correção de pH
É a última ação no processo de tratamento da água e tem por objetivo prevenir a corrosão dos encanamentos pelos quais a água tratada passa até chegar aos usuários. Para proteger as estruturas de armazenamento e distribuição, são aplicados produtos químicos que corrigem a acidez ou a alcalinidade excessivas presentes na água. Para formar uma película protetora de carbonato de sódio na superfície interna da tubulação, é preciso remover o gás carbônico livre e saturar a água com carbonato de sódio (barrilha leve). O pH da água de 6,0 a 9,5, na rede de distribuição, é uma recomendação da Portaria 2.914/11, do Ministério da Saúde. Os principais produtos químicos utilizados na correção de pH são: Cal Hidratada, o Carbonato de Sódio (geralmente os dois mais utilizados no processo), Carbonato de Cálcio, Hidróxido de Sódio, Gás Carbônico, Ácido Clorídrico e Ácido Sulfúrico.
pH – O potencial hidrogênio iônico aponta a intensidade com que a água ou outra solução é ácida, neutra ou alcalina com uma escala que varia de 0 a 14:
pH inferior a 7 = ácida
pH igual a 7 = neutra
pH superior a 7 = alcalina
No tratamento da água, busca-se como parâmetro um pH ótimo de floculação e decantação.
Alcalinidade - Capacidade da água em neutralizar ácidos sem perturbação excessiva de suas atividades biológicas. A presença de sais de ácidos fracos, especialmente bicarbonatos, resulta da ação da água sobre os carbonatos atuantes no solo, como, por exemplo, bicarbonatos de cálcio. Quando feito exame em laboratórios, são indicados os valores da alcalinidade total, de bicarbonatos e de carbonatos, não sendo possível a coexistência de três formas de alcalinidade na mesma amostra. A alcalinidade se deve aos carbonatos e bicarbonatos e, em segundo plano, aos íons hidróxidos, silicatos, boratos, fosfatos e amônia. A alcalinidade total é a soma de todos esses íons.
Hidróxido de cálcio
O hidróxido de cálcio, de fórmula Ca(OH)2, em estado puro é um pó branco e inodoro, alcalino (pH 12,8) e pouco solúvel em água (1,2 g/litro de água a 25º C). Chamado também de cal hidratada, cal apagada ou cal extinta, tem base forte obtida pelo aquecimento do carbonato de cálcio até se transformar em óxido de cálcio (cal viva ou cal virgem, CaO). Com a hidratação do óxido de cálcio, chega-se ao hidróxido de cálcio. A reação entre o hidróxido de cálcio e o gás carbônico dá origem ao carbonato de cálcio. Sua utilização no tratamento da água é na etapa de Coagulação, que explicamos na primeira parte do nosso especial, quando da retirada de pequenas partículas em suspensão, é adicionado à água sulfato de alumínio Al2(SO4)3, hidróxido de cálcio Ca(OH)2, ou barrilha, e Na2CO3 (carbonato de sódio) para formar um precipitado gelatinoso com partículas aglutinadas. Além de seu uso no tratamento da água, há diversas aplicações para o hidróxido de sódio.
Carbonato de cálcio
O carbonato de cálcio (CaCO3), também conhecido como calcita, é um sólido branco pouco solúvel na água. Mineral inorgânico de química inerte com perfil alcalino se decompõe por aquecimento e forma o óxido de cálcio (cal viva) e dióxido de carbono.
Extraído de jazidas, encontra-se na natureza nos minerais calcita e aragonita, além de pérolas, conchas marinhas e cavernas calcárias. De acordo com a aplicação para qual for utilizado, é submetido a processos e apresentado em diversas granulometrias. No tratamento da água, a acidez mineral da água consiste no total de ácidos presentes nela. Expressa em mg/L de carbonato de cálcio e relacionada ao pH final da água, aponta a quantia deste produto químico a ser acrescentada para torná-la alcalina.
Carbonato de sódio
O carbonato de sódio (Na2CO3) é um sal branco e translúcido também chamado de soda calcinada ou soda sal. Quando em exposição ao ar, endurece e se agrupa porque forma hidratados. Além da utilização no controle do pH da água e formação da película protetora na tubulação, pode ser usado na produção de vidro, sínteses químicas, sabões e detergentes, fotografia, área têxtil, como aditivo alimentar, entre outros. Se jogado em aterros ou corpos d’água, provoca alcalinização, chegando a causar danos à natureza. Funciona como base em reações e tem facilidade de ser protonado por espécies ácidas.
Hidróxido de sódio
O hidróxido de sódio (NaOH) é a conhecido como soda cáustica, sólido branco e inodoro que, por ser corrosivo, é utilizado normalmente para desobstruir encanamentos. Além do tratamento de resíduos nos efluentes pela mudança de pH, o também chamado hidróxido cáustico tem outras aplicações. Com base forte de Arrhenius e produzido por eletrólise de solução aquosa de cloreto de sódio, exerce a função, entre outras, de base química na fabricação de papel, tecidos, detergentes, alimentos e biodiesel. Também conhecido pelos cuidados que se deve ter ao manuseá-lo, por ser altamente reativo, pode causar queimaduras, cicatrizes, cegueira e levar até a morte.
|
|---|